如何实现饲用抗生素(AGPs)的高效替代?(下篇)
2022年9月15日
黑曲霉菌培养物蛋鸡饲养实验报告在Animals杂志发表
2022年9月15日可肥酸-50猪长期饲喂及体内消除规律试验报告

可肥酸-50猪长期饲喂及体内消除规律试验报告
肖霞,张寒,刘为,王志强
(扬州大学兽医学院,江苏扬州225009)
摘要:为了检测长期饲喂饲料添加剂可肥酸-50后猪肠道内苯甲酸及其代谢物(马尿酸)的浓度。本研究首先建立了猪小肠内容物中苯甲酸及马尿酸的高效液相色谱(HPLC)检测方法,采用乙酸乙酯作为提取剂,亚铁氰化钾和乙酸锌作为蛋白沉淀剂,提取内容物样品中苯甲酸。采用水、亚铁氰化钾和乙酸锌共同提取猪肠道内容物样品中的马尿酸。猪小肠内容物中苯甲酸检测限和定量限均分别为0.05 μg/g和0.5μg/g,平均回收率为(101.8±2.41)%。小肠内容物中马尿酸的检测限和定量限均分别为0.1μg/g和0.5 μg/g,平均回收率为(89.16±3.35)%。18头1月龄仔猪,随机分为两组,饲料中分别添加苯甲酸5000 mg/kg饲料(对照组)或可肥酸-50 1670 mg/kg饲料(试验组),连续饲养3周。分别于给药后第7、14、21天采集小肠后1/4段的内容物,测定该内容物中苯甲酸及其代谢物马尿酸的含量。在三个时间点测得可肥酸-50组肠道内苯甲酸浓度均高于对照组;在第7、14天测得可肥酸-50组肠道内马尿酸的浓度低于对照组,但在21天时马尿酸浓度高于对照组。
关键词:猪;苯甲酸;马尿酸;HPLC;小肠内容物
1 材料和方法
1.1 药品 苯甲酸、马尿酸标准品由Solarbio公司提供,生产批号分别为703B022、309E021,纯度为99.9%;
1.2 试剂 甲醇,HPLC级,购自上海麦克林生化技术有限公司;磷酸,HPLC级,购自德国CNW Technologies GmbH;乙酸铵,HPLC级,购自上海沪试实验室器材股份有限公司。其他所用试剂,除特殊注明外均为分析纯试剂;水为符合《GB/T6682-2008分析实验室用水国家标准》规定的超纯水。
1.3 仪器 Agilent-1260型高效液相色谱仪,配有紫外检测器和色谱工作站,购自Agilent Technologies公司;色谱柱为UltimateR XB-C18 柱(4.6 mm× 250 mm,5 µm),购自Agilent Technologies公司;KS-250D超声仪购自宁波科生仪器厂产品;水浴氮吹仪购自Organomation America;Centrifuge 5810R高速冷冻离心机购自Eppendorf。
1.4 溶液的配制 准确称取苯甲酸(马尿酸)标准品(0.02g)于10 mL棕色容量瓶中,加入适量甲醇,震荡溶解后定容至刻度,即配成浓度为2000 µg/mL 苯甲酸(马尿酸)标准储备液,分装后置-20℃下保存,有效期6个月;分别取甲醇、0.02%磷酸水作为检测苯甲酸浓度的流动相、取甲醇、乙酸铵溶液作为检测马尿酸浓度的流动相,经孔径 0.22 µm滤膜过滤,超声脱气。流动相现配现用。
1.5 肠内容物样品前处理过程
1.5.1苯甲酸提取 称取猪小肠后1/4内容物样品(2.00± 0.02)g于50 mL离心管中,加入乙酸乙酯6ml,60℃水浴下超声20 mim,冷却至室温后加入蛋白沉淀剂亚铁氰化钾、乙酸锌各2ml,涡旋1 min,6000×g离心5 min,取上清移至10 mL离心管中。40℃氮吹至干。加入流动相1 mL涡旋5min复溶,溶液经孔径0.22 µm有机滤膜过滤,收集滤液供HPLC检测。
1.5.2 马尿酸提取 称取猪小肠后1/4内容物样品(1.00± 0.02)g于10 mL离心管中,加入水1ml,60℃水浴下超声20 mim,冷却至室温后加入蛋白沉淀剂亚铁氰化钾、乙酸锌各2ml,涡旋1 min,6000×g离心5 min,取上清经孔径0.22 µm有机滤膜过滤,收集滤液供HPLC检测。
1.6 色谱条件优化 色谱柱为UltimateRXB-C18 柱(4.6 mm× 250 mm,5 µm),苯甲酸检测所使用流动相为甲醇:0.02%磷酸水(40∶60,v/v),流速为1 mL/min,柱温为25℃,进样量为10 µL,紫外检测波长为230nm;马尿酸检测使用的流动相为甲醇:乙酸铵溶液(10∶90,v/v),流速为1 mL/min,柱温为25℃,进样量为10 µL,紫外检测波长为230nm。
1.7 方法学研究
1.7.1 标准曲线和线性范围 精密量取2000 µg/mL 苯甲酸(马尿酸)标准储备液适量,依次用流动相稀释,配置苯甲酸浓度分别为10、5 、1、0.5 、0.1 和0.05 µg/ml标准溶液,经0.22 µm滤膜过滤后,作为待检标准溶液;精密量取2000 µg/mL 苯甲酸(马尿酸)标准储备液适量,依次用流动相稀释成200、100、20、10、2、1µg/mL系列标准工作液,称取空白猪小肠内容物后,再分别加入100 µL上述工作溶液,使样品添加浓度分别为10、5 、1、0.5 、0.1 和0.05 µg/g,另设空白组织对照。以1.5方法处理各样品。以苯甲酸色谱峰面积对应苯甲酸浓度进行线性回归,求出回归方程和相关系数。每个浓度重复3次。
1.7.2 检测限(limit of detection,LOD)和定量限(limit of quantity,LOQ) 取空白肠内容物添加苯甲酸(马尿酸)标准工作液,使得苯甲酸(马尿酸)在空白组织中的浓度分别为0.05、0.1和0.5 µg/g,按1.5组织样品前处理方法处理后,进行HPLC分析。测定基线噪声值,将信噪比(S/N)≥3定为检测限(LOD);定量限则结合精密度和准确度测定结果确定,以S/N≥10时的添加浓度作为定量限(LOQ)。
1.7.3 回收率的测定 将一定浓度的苯甲酸(马尿酸)标准工作液各100 µL加至空白样品中,制得10、5 、1、0.5 和0.1 µg/g 五个浓度的苯甲酸空白添加样品,按1.5组织样品前处理方法处理后,供HPLC分析,测定峰面积。然后与相应标准品加入空白组织处理后样品进样的峰面积进行比较,计算相对添加回收率。每个添加浓度重复3次。
1.7.4 准确度和精密度的测定 将一定浓度的苯甲酸(马尿酸)标准工作液各100 µL加至空白组织中,制得10、5 、1、0.5 和0.1 µg/g 五个浓度的苯甲酸(马尿酸)空白组织添加样品,按1.5组织样品前处理方法处理后,供HPLC分析。每个浓度设3个平行(日内),共重复3批(日间)。据此分别求出日内和日间变异系数。
1.7.5 数据处理 Agilent-1260型高效液相色谱工作站提取并处理色谱图,数据用SPASS软件进行处理。
1.8 动物试验实测方案 18头猪,体重约10kg,如表1随机均分为2组,饲料中分别添加苯甲酸或可肥酸-50,连续饲养3周。试验期间自由饮水和采食。另备三头作为空白组,饲养一周后采样检测。
正式实验开始第7、14、21天,每次杀3只猪,分别采集小肠后1/4段的内容物,测定该内容物中苯甲酸及其代谢物(马尿酸)的含量。

2 结果
2.1检测方法验证结果
2.1.1 色谱结果 在本试验建立的检测条件下,与肠内容物中其他基质组分完全分开,猪肠道内容物中苯甲酸的出峰时间在9.2 min左右,马尿酸的出峰时间在 6.9min左右。
2.1.2 线性关系 苯甲酸药物浓度在0.05~10µg/g范围内,药物浓度与峰面积呈良好的线性关系(R2≥0.9995);马尿酸药物浓度在0.1~20µg/g范围内,药物浓度与峰面积呈良好的线性关系(R2≥0.9995)。
2.1.3 检测限和定量限 取信噪比S≥3时的浓度为最低检测限,该方法检测限为0.05µg/g;根据精密度和准确度测定结果,确定方法的定量限为0.5 µg/g。
2.1.4 回收率和精密度 苯甲酸(马尿酸)在肠内容物10、5 、1、0.5 和0.1 µg/g五个添加浓度下,其回收率及精密度测定结果见表2。除苯甲酸添加0.05µg/g和马尿酸添加0.1µg/g浓度外,回收率均大于75.57%,日内和日间变异系数分别小于5.93%和9.96%。
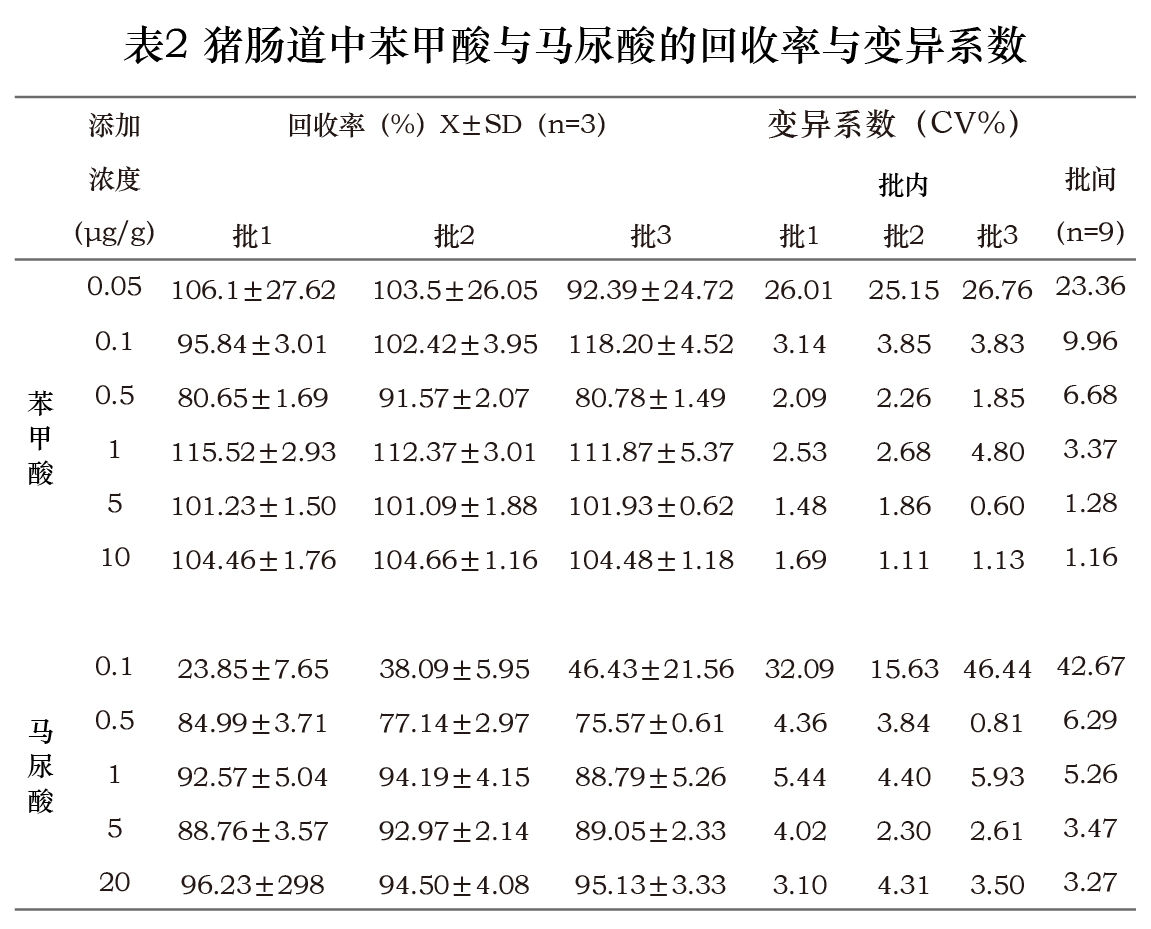
2.2动物实验实测结果
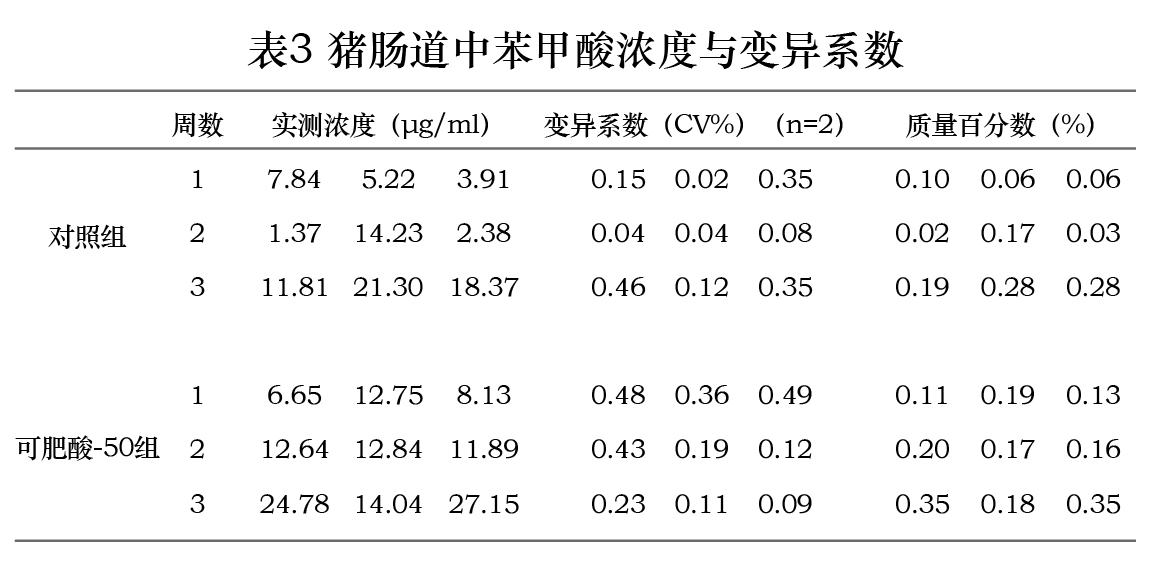
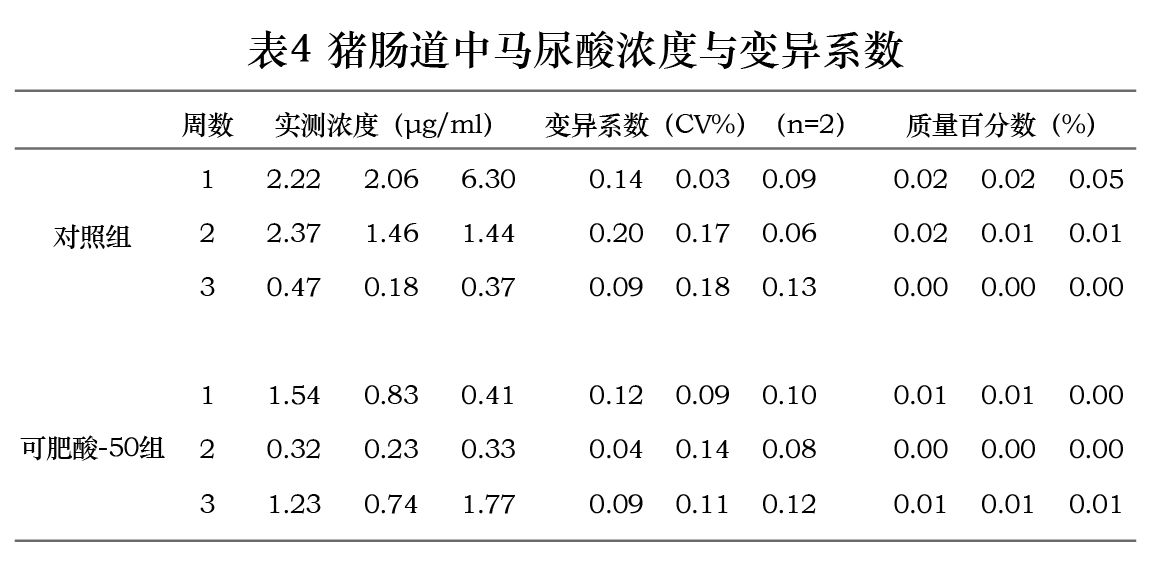
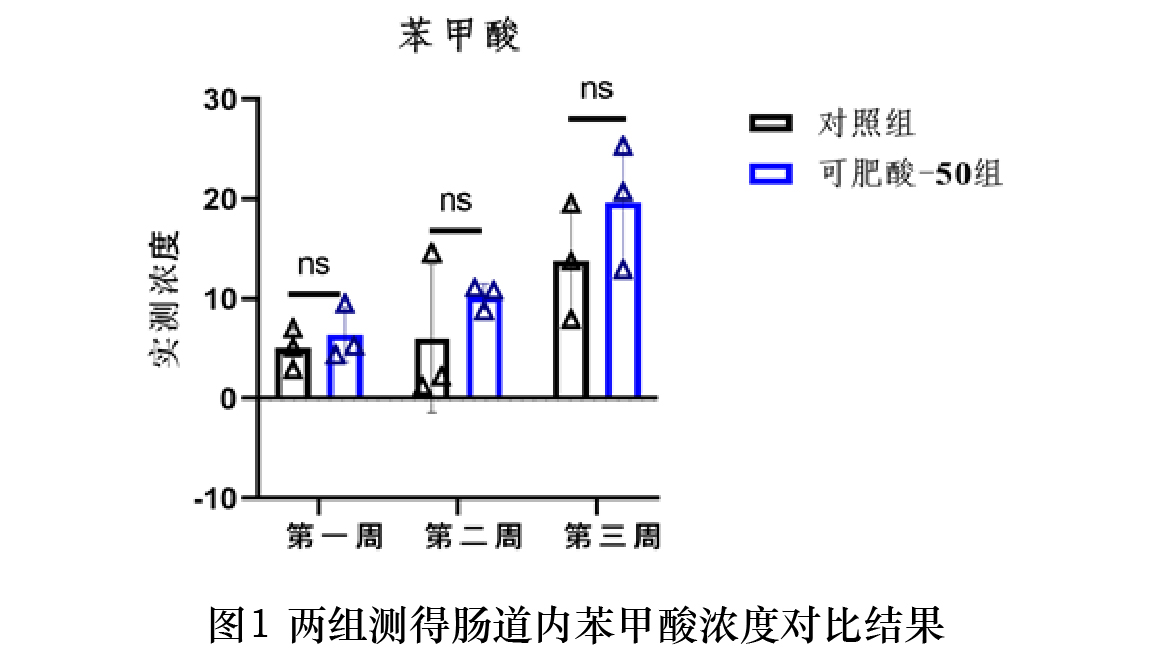
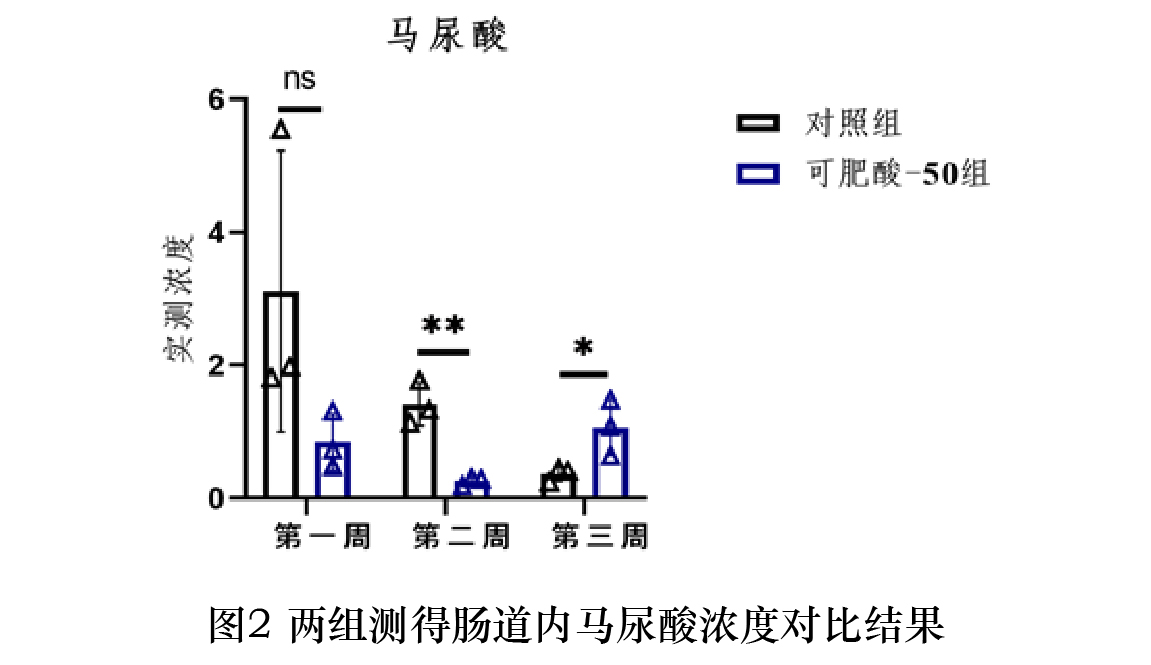
在本研究所建立的检测条件与样品处理方法下,测得空白组肠道内苯甲酸浓度为0.68µg/ml,马尿酸浓度低于定量限。对照组与可肥酸-50组中猪肠道内苯甲酸与马尿酸浓度与变异系数检测结果见表3、4。两组实测浓度对比结果见图1、2。在三个时间点测得可肥酸-50组肠道内苯甲酸浓度均高于对照组;在第7、14天测得可肥酸-50组肠道内马尿酸浓度低于对照组,而第21天马尿酸浓度高于对照组。
3 结论
在1月龄仔猪饲料中添加1670 mg/kg可肥酸-50,连续饲喂三周,给药后第7、14、21天采集小肠后1/4段的内容物,测得苯甲酸的浓度在三个时间点均高于添加5000 mg/kg苯甲酸(对照组),但差异不显著;在第7天测得可肥酸-50组肠道内马尿酸的浓度低于对照组,但差异不显著,第14天测得可肥酸-50组肠道内马尿酸浓度显著低于对照组,而在21天时小肠内容物中马尿酸的浓度显著高于对照组。
— End —